¿La ley de Boyle-Mariotte justifica la relación entre la presión y el volumen?
Introducción: La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert Boyle y Edme Mariotte, es una de las leyes de los gases ideales que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que el volumen es inversamente proporcional a la presión:
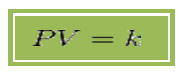
Donde  es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
Cuando el número de moles y la temperatura de un gas se mantienen constantes, un aumento en la presión ejercida sobre un gas resulta en una reducción de su volumen (compresión).Es decir que la relación entre volumen y presión de un gas es inversa: a mayor presión, menor volumen y viceversa.En un sistema que es sometido a presión, el producto de la presión yvolumen inicial es igual al producto de la presión y volumen finales.Esta es la llamada Ley de Boyle.Esta ley es una simplificación de la ley de los gases ideales o perfectos particularizada para procesos isotermos de una cierta masa de gas constante. Junto con la ley de Charles, la ley de Gay-Lussac, la ley de Avogadro y la ley de Graham, la ley de Boyle forma las leyes de los gases, que describen la conducta de un gas ideal. Las tres primeras leyes pueden ser generalizadas en la ecuación universal de los gases.
Nos hemos apoyado en un experimento donde se explica la Ley de Boyle. El vídeo de este experimento lo podemos encontrar en el siguiente enlace: https://fq-experimentos.blogspot.com/2009/09/ley-de-boyle.html.
Como ya hemos dicho, la Ley de Boyle establece que, a temperatura constante, el volumen y la presión de un gas son inversamente proporcionales:
|
|
- Para realizar nuestro experimento necesitamos una jeringa grande y unos globos de colores pequeños.
Acción didáctica:
- En el primer caso, al empujar el émbolo el aire atrapado en el interior de la
jeringa se comprime (disminuye el volumen) y, según la Ley de Boyle, aumenta la presión. Al aumentar la presión externa sobre el globo disminuye su volumen hasta que la presión interna iguale a la presión externa.
- En el segundo caso, al tirar del émbolo el aire atrapado en el interior de la jeringa se expande (aumenta el volumen) y, según la Ley de Boyle, disminuye la presión.
Al disminuir la presión externa al globo aumenta su volumen hasta que la presión interna iguale a la presión externa..
